Γλωσσάριο
Αδιαβατική
διαδικασία (ή μεταβολή):
Αντιστρεπτή
μεταβολή (ή διαδικασία):
Θερμοδυναμικοί
βαθμοί ελευθερίας :
Θερμοδυναμικός
νόμος Β (διατύπωση του Clausius)
:
Θερμοδυναμικός
νόμος Β (διατύπωση των Kelvin
Planck) :
Θερμοδυναμικός
νόμος Γ( ή θεώρημα του Nernst)
:
Θερμοχωρητικότητα
υπό σταθερή πίεση :
Θερμοχωρητικότητα
υπό σταθερό όγκο :
Θεώρημα
ισοκατανομής της ενέργειας :
Ισοβαρής
διαδικασία (ή μεταβολή) :
Ισόθερμη
διαδικασία (ή μεταβολή) :
Ισόχωρη
διαδικασία (ή μεταβολή) :
Κυκλική
μεταβολή (ή διαδικασία):
Μη
αντιστρεπτή μεταβολή ( ή διαδικασία) :
Σύνδεση
αντιστάσεων παράλληλα:
Συντελεστής
απόδοσης θερμικής μηχανής Carnot :
Συντελεστής
της αδιαβατικής μεταβολής :
![]()
Αδιαβατική διαδικασία (ή μεταβολή):
Είναι η διαδικασία κατά την οποία δεν έχουμε ανταλλαγή θερμότητας του συστήματος με το περιβάλλον. Εδώ το έργο κατά την μεταβολή του αερίου, είναι αντίθετο της μεταβολής της εσωτερικής ενέργειας του αερίου. (w=-ΔU)
Ampere:
Η μονάδα μέτρησης της έντασης του ρεύματος στο S.I.
Αμπερόμετρο:
Είναι το όργανο που χρησιμοποιούμε για να μετράμε την ένταση του ηλεκτρικού ρεύματος.
Αντίσταση R ενός αγωγού:
Αντίσταση R ενός αγωγού ονομάζουμε το μονόμετρο μέγεθος, που ισούται με το πηλίκο της τάσης V, που εφαρμόζεται στα άκρα του, προς την ένταση του ρεύματος που τον διαρρέει. Δηλαδή:
Αντιστρεπτή μεταβολή (ή διαδικασία):
λέγεται μια μεταβολή που αποτελείται από μια σειρά
διαδοχικών καταστάσεων ισορροπίας, και μπορεί να διαγραφεί και κατά τις δύο
δυνατές φορές. Σε μια αντιστρεπτή μεταβολή μπορούμε να περάσουμε από την τελική
κατάσταση στην αρχική μέσω των ίδιων ενδιάμεσων καταστάσεων όπως και στην
αρχική διαδικασία. Μια τέτοια μεταβολή παριστάνεται σε ένα διάγραμμα P-V με μια
συνεχή καμπύλη.
Απόλυτη θερμοκρασία :
Είναι η θερμοκρασία που προκύπτει από τη θερμομετρική
κλίμακα Kelvin, στην οποία η ένδειξη
μηδέν αντιστοιχεί στο απόλυτο μηδέν. Η απόλυτη θερμοκρασία συμβολίζεται με Τ
και η μετατροπή από κλίμακα Celsius σε
κλίμακα Kelvin, γίνεται με τη βοήθεια
της εξίσωσης: Κ =
Απόλυτο μηδέν :
Είναι η θερμοκρασία στην οποία σύμφωνα με τον τρίτο θερμοδυναμικό νόμο, οποιεσδήποτε αλλαγές κατάστασης γίνονται χωρίς μεταβολή της εντροπίας.
Volt:
Η μονάδα μέτρησης της τάσης στο S.I.
Βολτόμετρο:
'Eνταση ηλεκτρικού ρεύματος:
Η ένταση I του ηλεκτρικού ρεύματος που διαρρέει έναν αγωγό ισούται με το πηλίκο του φορτίου q, που περνά από μια διατομή του αγωγού σε χρόνο t, προς το χρόνο t.
Eπιτάχυνση
H μεταβολή της ταχύτητας προς το
χρόνο που πραγματοποιήθηκε ή ο "ρυθμός μεταβολής της ταχύτητας"
![]() μονάδα
μέτρησης της επιτάχυνσης στο S.I.
είναι το m/s2
μονάδα
μέτρησης της επιτάχυνσης στο S.I.
είναι το m/s2
Εσωτερική ενέργεια :
είναι η ενέργεια που συνδέεται με όλες τις δυνατές χαοτικές
κινήσεις των σωματιδίων του συστήματος και με την μεταξύ τους αλληλεπίδραση,
συμπεριλαμβανομένης και της αλληλεπίδρασης στο εσωτερικό των σύνθετων
σωματιδίων. Στην εσωτερική ενέργεια δεν συμπεριλαμβάνεται η κινητική ενέργεια
που συνδέεται με την κίνηση του κέντρου μάζας του συστήματος συνολικά, ούτε η
δυναμική ενέργεια του συστήματος λόγω της επίδρασης πάνω του εξωτερικών πεδίων.
Η εσωτερική ενέργεια είναι ένα μέγεθος του οποίου μόνο οι μεταβολές είναι
χρήσιμες και επομένως μας ενδιαφέρουν. Επιπλέον δύο σημαντικές ιδιότητες της
είναι ότι η μεταβολή της μεταξύ δυο καταστάσεων ισορροπίας Α και Β, εξαρτάται
μόνο από τις καταστάσεις αυτές και όχι από τον τρόπο που έγινε η μεταβολή αυτή.
Στην περίπτωση που ένα αέριο βρίσκεται σε συνήθεις συνθήκες λόγω της χαμηλής
του πυκνότητας και των κατά συνέπεια μικρών δυνάμεων μεταξύ των μορίων, η
εσωτερική ενέργεια είναι συνάρτηση μόνο της θερμοκρασίας και της μάζας του.
Θερμικές μηχανές :
Είναι μηχανές οι οποίες μετατρέπουν τη θερμική ενέργεια σε
ωφέλιμο μηχανικό έργο και λειτουργούν κυκλικά. Στο τέλος κάθε κύκλου η μηχανή
επιστρέφει στην αρχική της κατάσταση, αφού έχει αποδώσει πρώτα κάποιο έργο,
διαδικασία η οποία επαναλαμβάνεται για όσο χρόνο η μηχανή λειτουργεί. Κατά τη
διάρκεια ενός κύκλου, η θερμική μηχανή, απορροφά ποσό θερμότητας Qh από μια δεξαμενή υψηλότερης θερμοκρασίας Τh, ένα μέρος της οποίας μετατρέπει σε μηχανικό έργο W, ενώ το υπόλοιπο το απορρίπτει σαν «άχρηστη θερμότητα» Qc σε μια δεξαμενή χαμηλότερης θερμοκρασίας Τc .
Θερμική Ισορροπία :
Όταν ρίχνουμε ζεστό νερό σε κρύο φλυτζάνι
το φλυτζάνι ζεσταίνεται. Η θερμοκρασία του ζεστού
νερού μειώνεται και η θερμοκρασία από το φλυτζάνι
μεγαλώνει. Μετά από λίγη ώρα το φλυτζάνι και το νερό
αποκτούν την ίδια θερμοκρασία. Τότε λέμε ότι τα δύο σώματα βρίσκονται σε θερμική
ή πιο ορθά σε θερμοδυναμική ισορροπία.
Θερμική μηχανή Carnot :
Είναι μια μηχανή που λειτουργεί με αντιστρεπτό τρόπο.
Αποτελείται από έναν κύλινδρο, που φράσσεται με έμβολο το οποίο κινείται χωρίς
τριβή. Οι παράπλευρες επιφάνειες του καθώς και το έμβολο είναι θερμικά
μονωμένες, ενώ η βάση του άλλοτε είναι θερμοαγώγιμη
και άλλοτε θερμικά μονωμένη. Μέσα στον κύλινδρο υπάρχει ιδανικό αέριο. Η
λειτουργία της μηχανής στηρίζεται σε μια πορεία που περιέχει δυο ισόθερμες και
δύο αδιαβατικές μεταβολές . Η κυκλική μεταβολή που
ακολουθεί μια μηχανή Carnot,
λέγεται κύκλος Carnot. Είναι προφανές ότι μια
τέτοια μηχανή δεν μπορεί να πραγματοποιηθεί, είναι επομένως μια ιδανική μηχανή
την οποία κατασκευάζουμε για να μελετήσουμε για θεωρητικούς σκοπούς.
Θερμοδυναμικό σύστημα:
ονομάζουμε κάθε σύστημα το οποίο για να μελετηθεί είτε σε
κατάσταση θερμοδυναμικής ισορροπίας είτε σε κάποια μεταβολή του πρέπει να
λαμβάνουμε υπ’ όψη τις ενεργειακές μεταβολές που συμβαίνουν τόσο από έργα
δυνάμεων που επιδρούν στο σύστημα όσο και λόγω θερμικών αλληλεπιδράσεων με το
περιβάλλον (θερμότητα)
Θερμοδυναμικοί
βαθμοί ελευθερίας :
είναι το πλήθος των ανεξάρτητων μεταβλητών που απαιτούνται
για να γνωρίζουμε την ενέργεια ενός μορίου του θερμοδυναμικού
συστήματος. Για παράδειγμα η κίνηση ενός μονοατομικού
μορίου προσδιορίζεται από τρεις μεταβλητές τις υΧ,
υΨ , υΖ
και επομένως έχει τρεις βαθμούς ελευθερίας.
Θερμοδυναμικός
νόμος Α:
Η ενέργεια που προσφέρεται ή αφαιρείται από ένα σύστημα,
οδηγεί τόσο στην μεταβολή της εσωτερικής του ενέργειας, όσο και στην εκτέλεση
κάποιου έργου, δηλ. dQ = dU + dW . Ο πρώτος θερμοδυναμικός νόμος
είναι εφαρμογή της αρχής διατήρησης της ενέργειας.
Θερμοδυναμικός
νόμος Β (διατύπωση του Clausius) :
Σε κάθε διαδικασία που συντελείται σε ένα απομονωμένο
σύστημα, η εντροπία δεν μειώνεται.
Θερμοδυναμικός
νόμος Β (διατύπωση των Kelvin Planck)
:
Είναι αδύνατον να κατασκευάσουμε θερμική μηχανή που να
μετασχηματίζει τη θερμική ενέργεια σε έργο κατά 100 %.
Θερμοδυναμικός
νόμος Γ( ή θεώρημα του Nernst) :
Στο απόλυτο μηδέν, οποιεσδήποτε αλλαγές της κατάστασης,
γίνονται χωρίς μεταβολή της εντροπίας.
Θερμότητα:
Είναι η ενέργεια που μεταφέρεται λόγω της διαφοράς
θερμοκρασίας δύο σωμάτων ονομάζεται θερμότητα και συμβολίζεται με Q.
Μονάδα μέτρησης της ενέργειας επομένως και της θερμότητας
είναι το 1 J.
Θερμοκρασία :
Στη καθημερινή ζωή η θερμοκρασία μας βοηθά να εκφράσουμε
πόσο ζεστό η πόσο κρύο είναι ένα σώμα. Για παράδειγμα το αναμμένο μάτι μιας
κουζίνας λέμε ότι έχει υψηλή θερμοκρασία ενώ ένα παγάκι λέμε ότι έχει χαμηλή
θερμοκρασία,. Η μικροσκοπική προσέγγιση μας δίνει ότι η θερμοκρασία (απόλυτη)
είναι ανάλογη της μέσης κινητικής ενέργειας των σωματιδίων.
Θερμοχωρητικότητα :
Αν σε ένα σύστημα προσφέρουμε θερμότητα dQ , τότε η θερμοκρασία του θα μεταβληθεί κατά dT. Η ποσότητα C = dQ/dT, ονομάζεται θερμοχωρητικότητα και εκφράζει τo ποσό της θερμότητας που χρειάζεται για να αυξηθεί η
θερμοκρασία του συστήματος (ή του σώματος), κατά ένα βαθμό Kelvin.
Θερμοχωρητικότητα υπό σταθερή πίεση :
Αυτή ορίζεται ως εξής CΡ = (dQ/dT)Ρ = (∂Η/∂T)Ρ , όπου Η η ενθαλπία
του συστήματος ( η ενθαλπία ορίζεται από τη σχέση : Η =U+pV ).
Θερμοχωρητικότητα υπό σταθερό όγκο :
Oρίζεται ως εξής CV = (δQ/dT)V = (dU/dT)V = (∂U/∂T)V .
Θεώρημα ισοκατανομής της ενέργειας :
Σε όλους τους βαθμούς ελευθερίας ενός στατιστικού συστήματος,
αντιστοιχεί η ίδια ενέργεια, που είναι ίση με ΚΤ/2 . O
παραπάνω ορισμός ονομάζεται θεώρημα ισοκατανομής της ενέργειας στους βαθμούς
ελευθερίας. Έτσι η εσωτερική ενέργεια ενός συστήματος σωματιδίων όπως π.χ. μια
ποσότητα αερίου, υπολογίζεται αν αντιστοιχίσουμε ενέργεια ΚΤ/2, σε κάθε
βαθμό ελευθερίας που προσδιορίζει την κίνηση κάθε σωματιδίου.
Θεώρημα του Carnot :
Σύμφωνα με το θεώρημα του Carnot, είναι αδύνατο να κατασκευαστεί θερμική μηχανή που να λειτουργεί μεταξύ δυο δεξαμενών θερμότητας και να έχει θερμικό συντελεστή απόδοσης μεγαλύτερο του συντελεστή απόδοσης μιας μηχανής Carnot.
Ηλεκτρικό ρεύμα:
Η προσανατολισμένη κίνηση ηλεκτρικών φορτίων.
Ιδανικό Αέριο :
Ιδανικό αέριο λέγεται ένα υποθετικό αέριο στα μόρια του οποίου δίνονται
οι ακόλουθες ιδιότητες: 1) τα μόρια του συμπεριφέρονται σαν μικρές όμοιες
ελαστικές σφαίρες που βρίσκονται σε διαρκή και τυχαία κίνηση, 2) μεταξύ
κινούμενων μορίων δεν ασκούνται δυνάμεις παρά μόνο κατά τη στιγμή που
συγκρούονται. Επομένως η μεταξύ δυο συγκρούσεων κίνηση είναι ευθύγραμμη και
ισοταχής, 3) ο χρόνος που διαρκεί η σύγκρουση είναι πολύ μικρός, 4) το μέγεθος
των μορίων σε σχέση με το χώρο που καταλαμβάνουν θεωρείται μικρό, έτσι ο
συνολικός τους όγκος είναι αμελητέος σε σχέση με το δοχείο που τα περιέχει, 5)
αποτελείται τέλος από μεγάλο πλήθος μορίων.
Ισοβαρής διαδικασία (ή μεταβολή) :
Είναι μια θερμική μεταβολή ορισμένης ποσότητας αερίου που γίνεται με
σταθερή πίεση, P = constant. Σε μια τέτοια διαδικασία για να αυξήσουμε τον όγκο του
συστήματος πρέπει να προσφέρουμε διαρκώς θερμότητα διατηρώντας σταθερή την
πίεση.
Ισόθερμη διαδικασία (ή μεταβολή) :
Είναι θερμική μεταβολή ορισμένης ποσότητας αερίου που πραγματοποιείται
υπό σταθερή θερμοκρασία Τ = constant. Σε μια
τέτοια διαδικασία επειδή η θερμοκρασία είναι σταθερή, η εσωτερική του ενέργεια
δεν μεταβάλλεται, γεγονός που σημαίνει ότι στην ισόθερμη διαδικασία όλη η
θερμότητα που προσφέρουμε μετατρέπεται σε έργο.
Ισόχωρη διαδικασία (ή μεταβολή) :
Είναι θερμική μεταβολή ορισμένης ποσότητας αερίου που πραγματοποιείται
διατηρώντας σταθερό τον όγκο, V = constant . Το έργο σε μια τέτοια διαδικασία, είναι προφανώς ίσο με
το μηδέν.
Καταστατική εξίσωση:
Καταστατική εξίσωση αερίου ονομάζουμε την εξίσωση που συνδέει τις τιμές
των θερμοδυναμικών παραμέτρων (p,V,T,n)
σε κατάσταση θερμοδυναμικής ισορροπίας.
Κυκλική μεταβολή (ή διαδικασία):
Είναι η διαδικασία κατά την οποία ξεκινάμε από μια κατάσταση Α και
καταλήγουμε στην ίδια κατάσταση. Στη μεταβολή αυτή η εσωτερική ενέργεια του
αερίου δεν μεταβάλλεται. Εδώ η προσφερόμενη ενέργεια με μορφή θερμότητας
μεταφέρεται, κατά ένα μέρος, μέσω έργου από το αέριο στο περιβάλλον. Σε ένα
διάγραμμα P-V, η μεταβολή παριστάνεται με μια
κλειστή καμπύλη.
Μη αντιστρεπτή μεταβολή ( ή διαδικασία) :
Mια μεταβολή στην οποία οι ενδιάμεσες καταστάσεις από τις οποίες περνάει το αέριο δεν είναι καταστάσεις ισορροπίας και η επιστροφή από την τελική κατάσταση στην αρχική μέσω των ίδιων ενδιάμεσων καταστάσεων είναι αδύνατη. Μια μη αντιστρεπτή μεταβολή, παριστάνεται σε διάγραμμα P,V με δυο σημεία (μόνο η αρχική και η τελική κατάσταση).
Νόμος του Ohm:
Ο νόμος του Ohm για αντιστάτη (μεταλλικό αγωγό) διατυπώνεται ως εξής:
Η ένταση του ρεύματος που διαρρέει έναν αντιστάτη (μεταλλικό αγωγό)
σταθερής θερμοκρασίας είναι ανάλογη της τάσης που εφαρμόζεται στα άκρα του. ![]()
Πίεση:
Η πίεση είναι αποτέλεσμα των κρούσεων των μορίων με τα τοιχώματα του δοχείου.
Για να είμαστε περισσότερο ακριβείς, η πίεση είναι ίση με την ορμή που
μεταδίδεται από όλα τα μόρια στη μονάδα της επιφάνειας, στην μονάδα του
χρόνου.
Στατική Τριβή: (Οριακή Τριβή)
Η στατική τριβή αναπτύσσεται στη διαχωριστική επιφάνεια δύο σωμάτων όταν το ένα τείνει να κινηθεί σε σχέση με το άλλο. Η τιμή της είναι αντίθετη με την δύναμη που ωθεί το σώμα και το μέτρο της κυμαίνεται από μηδέν μέχρι μια μέγιστη τιμή που ονομάζεται Οριακή Τριβή. Η οριακή τριβή ισούται με T=μ Fκαθ.. Όπου Fκαθ η κάθετη αντίδραση του δαπέδου και μ ο συντελεστής στατικής τριβής
Σύνδεση αντιστάσεων παράλληλα:
Η σύνδεση αντιστάσεων κατά την οποία όλες οι αντιστάσεις έχουν την ίδια τάση V, που είναι ίση με την ολική τάση Vολ.
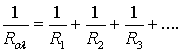 .
.
Σύνδεση αντιστάσεων σε σειρά:
Η σύνδεση αντιστάσεων κατά την οποία όλες οι αντιστάσεις διαρρέονται από την ίδια ένταση ρεύματος Ι, που είναι ίση με την ολική ένταση Ιολ.
![]()
Συντελεστής απόδοσης θερμικής μηχανής Carnot :
Ο συντελεστής απόδοσης της μηχανής Carnot, αποδεικνύεται ότι είναι ίσος με: n = (Th-Tc)/Th .
Συντελεστής της αδιαβατικής
μεταβολής :
συμβολίζεται με γ και ισούται με το πηλίκο της ειδικής θερμότητας υπό
σταθερή πίεση, προς την ειδική θερμότητα υπό σταθερό όγκο. Δηλαδή: γ = cP/cV .
Ταχύτητα:
Ταχύτητα είναι η διανυσματική ποσότητα που αναφέρεται στο
"πόσο γρήγορα κινείται ένα αντικείμενο" και εκφράζει την
"αλλαγή της θέσης ενός σώματος ως προς το χρόνο" ή
"ρυθμό μεταβολής της θέσης" Η μονάδα της ταχύτητας SI είναι το
μέτρο ανά δευτερόλεπτο [ m/s ] και καθορίζετατοι από
την εξίσωση: ![]()
Τριβή:
Τριβή Ολίσθησης
Η τριβή ολισθήσεως αναπτύσσεται στη διαχωριστική επιφάνεια
δύο σωμάτων όταν το ένα ολισθαίνει σε σχέση με ένα άλλο. Το μέτρο της τριβής
ολίσθησης δίνεται από τη σχέση: T=μ Fκαθ όπου μ είναι ο συντελεστής τριβής ολίσθησης και Fκαθ η κάθετη αντίδραση του δαπέδου. Η κατεύθυνσή της
είναι αντίθετη προς τη φορά κίνησης.
Φωτισμός
Ο φωτισμός μιας επιφάνειας ισσούται με τη φωτεινή ροή που
φτάνει σε μια επιφάνεια προς το εμβαδόν της επιφάνειας